この記事では、中学3年で習う塩酸の電気分解について解説します。
塩酸に電流を流した時に陽極で発生する気体、陰極で発生する気体や、化学反応式などです。
練習問題も用意しているので、ひととおり把握できたらぜひ解いてみてください!
※関連記事:化学反応式の一覧(分解、酸化、還元、化合、沈殿、中和):化学反応式の覚え方も解説
※関連記事:中2理科の酸化銅、塩化銅、硫化銅の化学式の一覧と実験内容
【中3理科】塩酸の電気分解の実験
中3理科で、塩酸の電気分解を習います。塩酸の電気分解の実験手順について説明します。
塩酸と電気分解の基本
塩酸は水に塩化水素(HCl)が溶けた酸性の液体で、化学式は「HCl」です。電気を流すとき、塩酸は電気分解を起こし、塩化水素の分子が分解して新しい物質ができます。
電気分解とは
まず、基本用語をおさらいします。電気分解とは水溶液に電気を流して化学反応を起こすことです。
電気が流れやすい性質(電解質といいます)のものでないと電気分解は起こりにくいです。塩酸以外に、塩化水素や水酸化ナトリウムは電気が流れやすいです。
これらもよくテストに出てきます。
なお、水酸化ナトリウムの電気分解については以下の記事でくわしく解説しています。
※関連記事:水酸化ナトリウムの電気分解:陽極陰極での反応や用語の解説(練習問題付き)
塩酸の電気分解の実験手順①~④
塩酸の電気分解の実験は以下のような手順で行います。
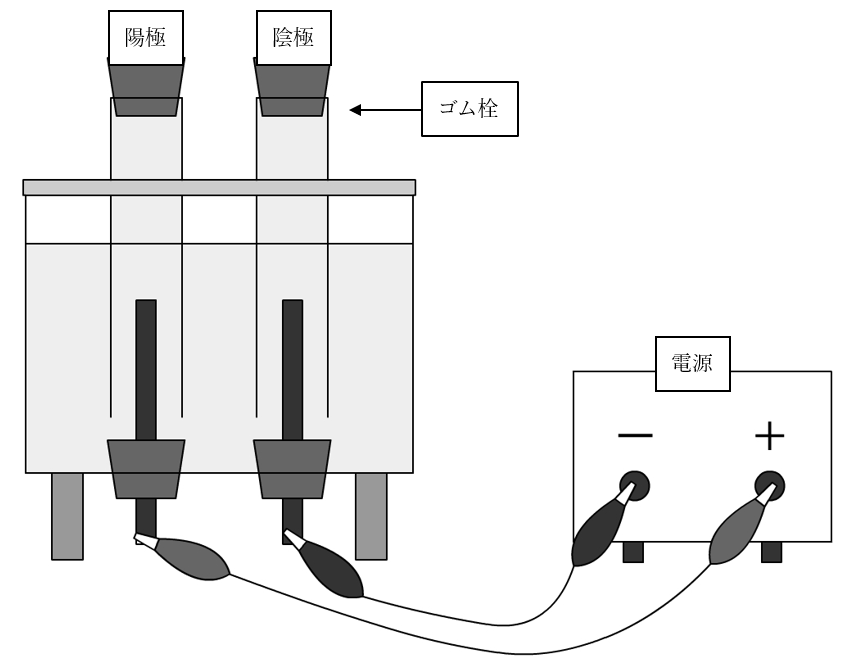
①以下のような電気分解装置にゴム栓を差し込む
②2.5%のうすい塩酸を入れる
③電気分解装置を電源につなぐ
④電流を流す
塩酸の電気分解の実験結果
この手順で実験すると、以下のような結果になります。
つまり、「塩酸に電流を流すと水素と塩素が発生する」ことが分かります。
陰極で発生する気体:水素
陰極(マイナス極)では、水素イオン(H⁺)が電子を受け取り、水素(H₂)として発生します。水素は無色・無臭です。
テストでは以下の特徴がよく出てきます。
火のついたマッチを近づけると、「ポン!」という音を立てて燃える
この音は水素特有の燃焼反応で、酸素と結びついて水が生成される瞬間に起こります。問題文にこの記述があると、「水素が発生した」と分かります。
陽極で発生する気体:塩素
陽極(プラス極)では、塩化物イオン(Cl⁻)が電子を放出し、塩素(Cl₂)として発生します。塩素も無色ですが、特有の刺激臭があります。
テストでは以下の特徴がよく出てきます。
これらの特徴はテストでもよく問われます。
塩酸の電気分解で発生する気体の量
実験によって発生する塩素と水素の量は2対1の割合になります。
塩素:水素=2:1
これは、塩酸の分子が電気分解されるときの化学反応式に基づくもので、水素分子(H₂)が2倍発生するためです。
例えば、100mlの塩酸を電気分解すると、水素が2倍の量で発生するので、水素が多くなるのが特徴です。
塩酸電気分解のテストによくでる重要ポイント
塩酸の電気分解の実験について、以下の内容がテストによく出るポイントです。

陰極側の反応
陰極のゴム栓を取ってマッチの火を近づけるとポンと音を立てて燃えます。
この反応の仕方から、水素が発生していると分かります。
陽極側の反応
陽極のゴム栓を取ってにおいをかぐと、プールを消毒するときのような刺激臭がします。さらに、管の上部にたまっている液を赤インクで着色した水につけると、色が消えます。
この「におい」と「色の変化」(漂白作用)から、塩素が発生していると分かります。
反応式を覚えるためのコツ
反応式を覚えるのが苦手な人には、分解後にできる物質に注目する方法がおすすめです。
たとえば、塩酸(HCl)の電気分解では、次の手順で覚えましょう。
分解される物質を確認
HClは水素(H)と塩素(Cl)に分かれます。
陰極と陽極で発生する物質を覚える
- 陰極では水素(H₂)が発生(プラスのH⁺が電子を受け取る)。
- 陽極では塩素(Cl₂)が発生(マイナスのCl⁻が電子を放出する)。
語呂合わせで暗記する
「陰(いん)キャは水素好き、陽(よう)キャは塩素好き」
陰極で水素、陽極で塩素が発生するイメージがつきます。
陽極と陰極を区別する楽しい方法
陽極(+)と陰極(-)を覚えるのが苦手な場合、次の工夫が役立ちます。
シンプルな語呂合わせにする
「プラスの陽気な陽極、マイナスの陰気な陰極」
プラスと陽、マイナスと陰を関連づけます。
実験の結果をイメージする
- 陽極は塩素ガスのにおい(プールのような刺激臭)が発生する。
- 陰極では水素ガスが「ポン」とはじける音がする。
実験の感覚を思い出すと、陽極と陰極の働きがイメージしやすくなります。
反復練習で定着させる
これらのコツを繰り返し実践し、テスト形式で問題を解くことで、電気分解の知識を確実に覚えられるようになります。
「語呂合わせ」や「実験結果をイメージ」する方法を活用して、自分なりの覚え方を工夫してみましょう!
塩酸の電気分解で生成される物質の特徴
塩酸(HCl)を電気分解すると、水素(H₂)と塩素(Cl₂)が発生します。それぞれの物質には特徴的な性質があり、多くの分野で活用されています。
ここでは、水素と塩素をイメージしやすくするために、それぞれの性質や用途を具体的に解説します。
水素(H₂)の性質と用途
水素の性質
- 軽い気体:水素は地球上で最も軽い気体で、空気よりもはるかに軽いです。
- 無色・無臭:見た目やにおいがなく、人の感覚では存在を感じられません。
- 可燃性:空気中で燃やすと青白い炎を出し、水(H₂O)を生成します。
- エネルギー効率が高い:燃焼時に副産物として水だけを生成するため、クリーンエネルギーとされています。
水素の用途
- 燃料電池:水素を使って電気を生み出す燃料電池車(FCV)や家庭用燃料電池システム(エネファーム)に利用されています。
- 宇宙開発:水素はロケットの燃料として使用され、エネルギー効率が高く、推進力が強いのが特徴です。
- 産業用途:鉄鋼や化学工業で原料として使用されるほか、油脂の水素化処理にも使われています。
塩素(Cl₂)の性質と用途
塩素の性質
- 刺激臭がある気体:塩素は鼻を刺すような独特のにおいがあり、少量でも強く感じます。
- 有毒性:塩素は高濃度では人体に有害で、吸い込むと呼吸器にダメージを与えることがあります。
- 酸化作用が強い:塩素は酸化力が非常に強く、細菌やウイルスを殺す効果があります。
- 水に溶けやすい:塩素は水に溶けると塩酸や次亜塩素酸を生成し、これが消毒効果を発揮します。
塩素の用途
- 消毒・殺菌:水道水やプールの消毒に使用されます。塩素の酸化作用によって病原菌を効果的に除去します。
- 塩化ビニル製品:塩素は塩化ビニル樹脂(PVC)の原料として利用され、ビニールホースや窓枠、建材などの製品に加工されます。
- 漂白剤:紙や布を漂白するための成分としても活用されています。
塩酸の電気分解の化学反応式
これらの実験結果を化学反応式で表すと以下のようになります。
2HCl→H2+Cl2
(塩化水素)→(水素)+(塩素)
塩酸の電気分解の練習問題
(1)塩酸を電気分解する実験で、陰極で発生した気体にマッチの火を近づけるとどうなりますか。
(2)(1)の結果から、陰極で発生した気体は何だと分かりますか。
(3)陽極の管の上部にたまった液体を、赤インクで着色した水に加えると色はどうなりますか。
(4)陽極で発生した気体からはプールを消毒したときのようなにおいがしました。このことから陽極付近で発生した気体は何だと分かりますか。
(5)塩酸の電気分解のようすを化学反応式で書いてください。
解答
(1)ポンと音を立てて燃える
(2)水素
(3)色が消える(無色になる)
(4)塩素
(5)2HCl→H2+Cl2
塩酸の電気分解に関するQ&A
Q1: 塩酸の電気分解とは何ですか?
A1: 塩酸の電気分解とは、塩酸(HCl)に電気を流して分解することで、水素(H₂)と塩素(Cl₂)の2つの気体を生成する反応のことです。
塩酸中の水素イオン(H⁺)と塩化物イオン(Cl⁻)がそれぞれ電子を受け渡して別々の気体になります。
Q2: 塩酸を電気分解すると、どんな気体が発生しますか?
A2: 塩酸を電気分解すると、陰極(マイナス極)で水素(H₂)、陽極(プラス極)で塩素(Cl₂)が発生します。陰極で水素が発生し、陽極で塩素が発生する仕組みです。
Q3: 陰極で発生する水素はどのように確認しますか?
A3: 陰極で発生した水素は、火のついたマッチを近づけると「ポン!」という音を立てて燃えます。この燃焼反応は水素の特徴であり、水素と酸素が反応して水ができるときに起こります。
この方法で水素が発生したことを確認できます。
Q4: 陽極で発生する塩素はどのように確認しますか?
A4: 陽極で発生した塩素は、色つきのろ紙を近づけることで確認できます。塩素は漂白作用があるため、ろ紙の色が脱色されます。また、塩素には特有の刺激臭があるので、においを感じることで塩素とわかります。
Q5: 電気分解の化学式はどうなりますか?
A5: 塩酸の電気分解の化学反応は次のように表されます。 2HCl→H2+Cl22HCl \rightarrow H₂ + Cl₂2HCl→H2+Cl2 この式のように、塩酸が電気の力によって水素と塩素に分かれるのが電気分解の過程です。
Q6: 陰極と陽極の違いは何ですか?
A6: 電気分解において、陰極(マイナス極)ではプラスのイオン(H⁺)が電子を受け取って水素ガスとして放出されます。一方、陽極(プラス極)ではマイナスのイオン(Cl⁻)が電子を放出し、塩素ガスとして放出されます。
中学理科のおすすめ問題集
最後に、理科のテスト勉強におすすめの問題集を紹介します。
『できた!中学理科』シリーズ(くもん)
1冊目は、くもん出版の「できた!」シリーズです。中1~中3で学年別に1分野・2分野の計6冊に分かれています。
書き込み式で、基礎的な問題から定期テストレベルまで演習を重ねられます。理科が苦手な中学生や理科を独学したい中学生におすすめです。
定期テストで平均点くらいまでカバーしています。
中1物理・化学はコチラ↓

できた!中1理科 物質・エネルギー(1分野) (中学基礎がため100%)
中1生物・化学はコチラ↓

できた!中1理科 生命・地球(2分野) (中学基礎がため100%)
中2物理・化学はコチラ↓

できた!中2理科 物質・エネルギー(1分野) (中学基礎がため100%)
中2生物・地学はコチラ↓

できた!中2理科 生命・地球(2分野) (中学基礎がため100%)
中3物理・化学はコチラ↓

できた!中3理科 物質・エネルギー(1分野) (中学基礎がため100%)
中3生物・地学はコチラ↓

できた!中3理科 生命・地球(2分野) (中学基礎がため100%)
出版社:くもん出版
難易度:易~標準(★☆☆)
『自由自在』
つづいては「自由自在」です。標準レベルから難関レベルまでカバーしている定番シリーズです。
定期テストで平均前後は取れていて、70-80点を取りたい人に向いています。
このシリーズの良いところは「情報量が圧倒的に多い」という点です。中学生用は参考書と問題集に分かれており、合わせて800ページ以上あります。
学年別に冊子が分かれていないのも使いやすいポイントです。3年間ずっと使い続けることもできますが、気になった範囲だけ自由自在で対策している中学生も多いです。
必要を感じたときだけ使うなら、冊子が分かれていないとテスト前になってあわてて問題集を買わずに済みます。
参考書↓

中学 自由自在 理科 : 中学生向け参考書/基礎から難関校受験(入試)まで (受験研究社)
問題集↓

中学 自由自在問題集 理科: 基礎から難関校突破まで自由自在の実力をつけるスーパー問題集 (受験研究社)
出版社:増進堂・受験研究社
難易度:標準~やや難(★★☆)
『最高水準問題集 理科』シリーズ
最後に紹介するのは「最高水準問題集シリーズ」です。ハイレベルな参考書・問題集でおなじみの文英堂が出している問題集です。
中1~中3と高校入試対策用に分かれています。教科書・定期テストレベルの問題はもう解ける、定期テストで90点台を安定して取りたい、難関私立大・国公立大に行きたい人向けです。
「最高水準問題集」と「最高水準問題集 特進」に分かれており、「特進」のほうが難問ぞろいです。
中1用↓

最高水準問題集 中1理科 (シグマベスト)
中1 特進↓

最高水準問題集 特進 中1理科
中2用はコチラ↓

最高水準問題集 中2理科 (シグマベスト)
中2 特進↓

最高水準問題集 特進 中2理科
中3用はコチラ↓

最高水準問題集 中3理科 (シグマベスト)
高校入試用はコチラ↓

最高水準問題集 高校入試 理科
中3・高校入試 特進↓

最高水準問題集 特進 中3理科
出版社:文英堂
難易度:難(★★★)
まとめ
いかがでしょうか。
中学生向けに塩酸の電気分解の様子を解説し、化学反応式を紹介しました。
陰極は電源の-極につなぎ、陽極は+極につなぎます。電流を流すと陰極では水素が発生し、陽極では塩素が発生します。陽極にマッチの火を近づけるとポンと音を立てて燃え、陰極からはプールを消毒したときのようなにおいがします。
これらの内容はテストにもよく出てきます。練習問題も解いて覚えておきましょう!

コメント